I mitocondri, universalmente conosciuti come le”centrali energetiche della cellula”, hanno una storia davvero affascinante, da semplici batteri a loro agio con l’ossigeno a organelli insostituibili di cellule grandi e complesse. La loro attività dipende da complessi di proteine la cui struttura e funzione è strabiliante nella loro complessità, raffinatezza ed efficienza; è proprio questa attività che li rende anche protagonisti dei processi di invecchiamento e senescenza, processi che possiamo rallentare con due delle più formidabili armi a nostra disposizione: dieta e attività fisica.
I mitocondri sono degli intrusi nelle nostre cellule, il frutto di uno degli eventi cruciali nell’evoluzione della vita sulla terra. Questi organelli sono infatti i lontani discendenti di antichi batteri in grado di utilizzare ossigeno per produrre energia, un trucco che nel passato ancestrale, probabilmente 2 miliardi di anni fa, era di fondamentale importanza, visto la crescita continua della concentrazione del reattivo elemento nell’atmosfera. Per noi l’ossigeno è sinonimo di vita, ma in quei giorni lontanissimi si trattava di una sostanza molto pericolosa, affamata di elettroni, che la maggior parte degli esseri viventi non solo non era in grado di utilizzare, ma sfuggiva come la peste.
È probabilmente in quel remoto passato che una cellula un poco più grande, incapace di sfruttare l’ossigeno, ha inglobato uno di questi batteri che con l’ossigeno invece ci sapeva fare: contro ogni possibile previsione, le due cellule, così diverse, hanno imparato a convivere, attraverso un lungo processo di adattamento durato più di un miliardo di anni, stabilendo una relazione simbiotica che ha reso possibile la nascita di cellule più grandi e complesse, le cellule eucariote, le stesse che formano il nostro corpo. Un evento straordinario perché la capacità di utilizzare l’ossigeno, caratteristica di questi batteri e conservata e raffinata negli organelli che da loro discendono, ha reso disponibile una grande quantità di energia per la cellula ospite, che ha potuto così aumentare di dimensione, specializzarsi e dare a origine a organismi pluricellulari.
I mitocondri conservano tracce del loro passato di procarioti, hanno infatti mantenuto un DNA indipendente, un anello di poco più di 16.000 nucleotidi che codifica per 13 proteine che sono costituenti essenziali delle complesse strutture grazie alle quali viene prodotta energia: il resto dei geni che codifica per le proteine mitocondriali è stato invece trasferito nel DNA nucleare della cellula “ospite”. I mitocondri sono trasmessi esclusivamente per via materna e ogni cellula ne contiene da qualche centinaio a qualche migliaio. Il numero effettivo dipende dalle esigenze energetiche della cellula: nel cuore, nei muscoli scheletrici e nel cervello, tessuti che hanno necessità di grandi quantità di energia, le cellule sono ricchissime di mitocondri, mentre i globuli rossi, che sono essenzialmente delle strutture di trasporto, ne sono privi.
La cellula con il più abbondante contenuto di mitocondri è l’ovulo, che li trasmette a tutte le cellule che da esso si originano dopo la fecondazione, mentre i mitocondri portati dallo spermatozoo vengono distrutti. I mitocondri si trasmettono quindi per via materna, uno dei motivi per cui le variazioni che si osservano nel DNA mitocondriale sono utilizzate per studi di genetica delle popolazione e biologia evoluzionistica. [1, 2]
Come sono fatti e come funzionano i mitocondri
Un singolo mitocondrio ha la forma di un bastoncello, con lunghezza molto variabile, che può arrivare fino a a 4 milionesimi di metro. L’organello è delimitato da due membrane, una esterna, che lo racchiude completamente, formata da fosfolipidi e da proteine che hanno funzione di trasporto e permettono il passaggio di materiale tra il citoplasma della cellula e il mitocondrio, e una interna, anche questa formata da fosfolipidi, con elevata presenza di cardiolipina, una molecola caratteristica di questa struttura, dove svolge un ruolo fondamentale in un gran numero di processi. La membrana interna è ricchissima di proteine, alcune con funzione di trasporto, altre impegnate nella produzione di energia. La membrana interna si ripiega a formare un gran numero di creste che ne espandono notevolmente la superficie e la capacità di produrre ATP. Le due membrane delimitano uno spazio intermembrana che ha un ruolo importante nei processi di sintesi dell’ATP.
Lo spazio interno del mitocondrio è chiamato matrice e contiene un gran numero di enzimi, impegnati in diverse vie metaboliche: ciclo dell’urea, produzione del gruppo eme, ciclo di Krebs e ossidazione degli acidi grassi.
La vulgata scientifica vuole che i mitocondri siano “la centrale energetica della cellula”, una definizione un poco riduttiva ma sostanzialmente corretta. È in questi organelli infatti che viene prodotto ATP (Adenosina Trifosfato) la molecola che è utilizzata per fornire energia a tutti i processi che avvengono nella cellula.
L’ATP è prodotto tramite un processo, la fosforilazione ossidativa, che permette di raccogliere l’energia liberata dall’ossidazione di glucosio, acidi grassi e aminoacidi e accumularla in questo prezioso composto che funziona poi — per citare un altro immortale luogo comune — da valuta energetica per tutti i processi cellulari sfavorevoli dal punto di vista termodinamico.
La fosforilazione ossidativa coinvolge una novantina di proteine organizzate in cinque strutture complesse, che insieme costituiscono la catena respiratoria, localizzate in un gran numero di copie sulla membrana interna del mitocondrio. In queste strutture gli elettroni provenienti dall’ossidazione di carboidrati e grassi, raccolti da molecole specializzate, NAD+ e FAD, sono sfruttati per accumulare protoni (H+) nello spazio tra le membrane del mitocondrio, e sono infine trasferiti all’ossigeno con formazione di acqua. I protoni accumulati nello spazio tra le membrane vengono utilizzati per formare ATP nello stesso modo in cui l’acqua di una diga è utilizzata per produrre energia elettrica: la cascata di protoni che dallo spazio intermembrana rifluiscono verso la matrice fornisce infatti energia ad una proteina—l’ATPasi del complesso V—che è una vera e propria turbina in grado di utilizzare il gradiente elettrochimico, la differente concentrazione di protoni tra lo spazio intermembrana e la matrice mitocondriale, per produrre quasi tutto l’ATP necessario alla cellula.
Il meccanismo è prodigioso nella sua raffinatezza, nella sua complessità e nella sua efficienza, tuttavia non è esente da problemi. Il passaggio di elettroni attraverso queste strutture è in effetti soggetto a perdite più o meno rilevanti, e l’entità di queste perdite è funzione di molti fattori diversi. Uno dei fattori più importanti è lo stato energetico della cellula: quando la cellula deve produrre molta energia, come avviene quando si fa attività fisica intensa, l’efficienza del sistema è massima e le perdite sono poche, i protoni infatti sono utilizzati molto rapidamente per produrre tutto l’ATP necessario; quando invece la richiesta di energia è bassa, pensate a un soggetto perennemente sedentario, l’efficienza del sistema cala drasticamente e le perdite salgono in maniera rilevante.
Qui abbiamo un problema: la perdita di elettroni da parte dei mitocondri non comporta soltanto una riduzione, più o meno importante della quantità di energia prodotta, ma ha conseguenze ben più importanti quando si parla di invecchiamento, porta infatti alla formazione di sostanze il cui solo nome incute timore e tremore: i radicali liberi!
I radicali liberi sono estremamente reattivi, in grado di strappare elettroni alle prime molecole che capitino loro a tiro, innescando reazioni a catena in cui il malcapitato composto che si è visto portar via un elettrone si trasforma a sua volta in un radicale libero che va a strappare elettroni ad altre molecole—lipidi, proteine, perfino DNA—in una successione che si propaga rapidamente e che può essere arrestata soltanto quando due radicali reagiscono tra loro formando composti stabili o per azione di antiossidanti, composti in grado di cedere elettroni e spegnere l’insaziabile sete dei radicali liberi, interrompendo così l’infausta catena che quando non è controllata può causare estesi danni alle delicate strutture della cellula.
Nei mitocondri, gli elettroni che sfuggono all’ordinato passaggio attraverso i complessi proteici della catena respiratoria reagiscono con l’ossigeno per formare diverse specie reattive (ROS Reactive Oxygen species o Specie reattive dell’ossigeno). I radicali liberi che si formano dall’ossigeno sono in grado di danneggiare tutte le molecole biologiche e nel mitocondrio possono produrre danni estesi al DNA mitocondriale, ai lipidi della membrana e alle numerose proteine presenti, riducendo la funzionalità dell’organello.
Il mitocondrio non è privo di difese e possiede una batteria di enzimi in grado di neutralizzare i ROS man mano che questi si formano. I due enzimi più attivi sono la superossido dismutasi (SOD) e la catalasi, la cui azione sequenziale permette di convertire i pericolosi ROS in innocue molecole di acqua e ossigeno.
I mitocondri sono in effetti una centrale energetica ma, come in tutte le centrali l’energia prodotta ha un costo che non è soltanto quello delle materie prime che vengono ossidate — le molecole che provengono dal cibo che consumiamo — ma è anche un costo “ambientale” legato alle rilevante produzione di radicali liberi, ancora più pericolosi vista la prossimità al DNA mitocondriale; quando trovate una molecola di fondamentale importanza nel cuore di un reattore che perde sostanze tossiche non vi aspettate che qualcosa possa andare storto? [3, 4]
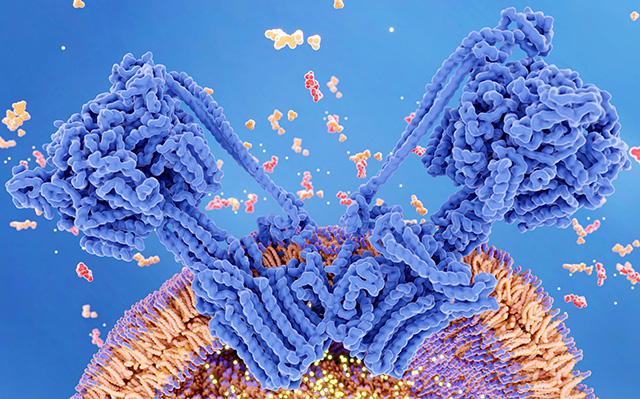
L’ATPasi del complesso V è il complesso enzimatico che nel mitocondrio rende possibile la sintesi di ATP grazie all’energia fornita dal flusso di protoni tra lo spazio intermembrana e la matrice mitocondriale, una vera e propria turbina grazie alla quale l’energia liberata dai processi di ossidazione dei nutrienti è accumulata nella sostanza utilizzata per fornire energia ai vari processi cellulari.
Mitocondri, radicali liberi e invecchiamento
I mitocondri fanno un lavoro pericoloso, maneggiano ossigeno, una sostanza molto reattiva, ed elettroni, particelle cariche di energia. Si formano radicali liberi che attaccano il DNA mitocondriale e altre strutture dell’organello, causando danni che ne alterano la funzionalità.
Questa osservazione è alla base della teoria di Denham Harman che nella sua forma più recente suggerisce che sono proprio i processi ossidativi causati dall’azione dei radicali liberi rilasciati dai mitocondri a determinare i danni e la perdita di funzione associata alla senescenza.
In effetti il DNA mitocondriale è soggetto a danni estesi dovuti all’azione dei radicali liberi, danni che si accumulano nel tempo e che sono particolarmente rilevanti in alcuni ceppi di topi che non posseggono gli enzimi necessari alla riparazione del DNA danneggiato e mostrano un invecchiamento più rapido e una ridotta durata della vita.
Tuttavia, le mutazioni del DNA mitocondriale non sono la sola causa del problema: come abbiamo visto questa molecola esiste in un gran numero di copie entro il singolo mitocondrio e perché la mutazione possa determinare effetti apprezzabili sarebbe necessario coinvolgesse oltre il 60% del DNA mitocondriale, mentre la percentuale osservata è decisamente più bassa.
Probabilmente sono in azione diversi meccanismi che nel tempo portano a una riduzione importante della funzionalità dei mitocondri, sia per una progressiva diminuzione del numero e delle dimensioni degli organelli presenti nella cellula, sia per un calo della loro efficienza, con aumento della produzione di radicali liberi, riduzione del numero di copie del DNA mitocondriale, riduzione della sintesi e dell’attività degli enzimi coinvolti nei processi metabolici che avvengono a livello di membrana e matrice, sensibile diminuzione della produzione di ATP e quindi della quantità di energia disponibile per i processi cellulari.
In questo complesso scenario i radicali liberi non sono sempre i cattivi della situazione: nei mitocondri invecchiati e poco efficienti è proprio l’accumulo di queste specie reattive a segnalare l’avvio di processi di autofagia che permettono di eliminare gli organelli non funzionali, insieme a proteine e altre molecole danneggiate.
Nei casi più estremi, quando la compromissione delle strutture cellulari è avanzata, sono ancora i mitocondri a innescare i processi che portano all’apoptosi, la morte cellulare programmata, che è essenziale per regolare i processi di sviluppo e crescita dei tessuti e per eliminare le cellule tumorali che si formano via via, ma può diventare un problema quando è attivata in maniera impropria e porta alla distruzione di cellule del sistema nervoso, come accade in alcune patologie neurodegenerative, o del muscolo cardiaco e scheletrico, come avviene nell’infarto, in alcune distrofie e, purtroppo, anche semplicemente invecchiando: si ritiene infatti che la sarcopenia, la riduzione del tessuto muscolare che si osserva in soggetti anziani, sia almeno in parte legata a processi di questo tipo.
Può accadere, con meccanismi che ancora non sono stati ben chiariti, che i processi di autofagia e apoptosi che eliminano mitocondri e cellule danneggiate provochino il rilascio di frammenti del DNA mitocondriale, di cardiolipina e altre componenti del mitocondrio che possono attivare una complessa struttura, l’inflammasoma, che a sua volta stimolerà il rilascio di sostanze che inducono e sostengono processi infiammatori, TNF-α, IL-1α/β, IL-8, IFNγ. Queste sostanze hanno un ruolo non secondario nei processi di senescenza cellulare, tanto che da diversi anni si parla di inflammaging, un termine che indica l’insieme dei processi infiammatori cronici, di basso livello, estesi a diversi tessuti e organi, che gioca un ruolo importante nell’invecchiamento e nella genesi di patologie cardiovascolari, metaboliche e degenerative.
In definitiva, è evidente che esiste un legame tra funzione mitocondriale e invecchiamento, ma la natura di questo legame è ancora in parte da decifrare. Un forte stress ossidativo, con aumento della produzione di radicali liberi, è problematico ma i radicali liberi rilasciati portano ad un aumento dei meccanismi di difesa che non solo mitigano lo stress ma stimolano anche la sintesi di nuovi mitocondri, un processo importante nel mantenere la cellula attiva e funzionale. Allo stesso tempo — almeno sul modello animale — la riduzione dell’attività dei mitocondri, con conseguente aumento della produzione di ROS, porta ancora all’attivazione di complessi meccanismi che permettono di mitigare lo stress ossidativo, anche in questo caso tramite eliminazione dei mitocondri disfunzionali e sintesi di nuovi.
Si tratta di processi molto complessi, regolati da delicati equilibri tra un gran numero di componenti diverse, la cui azione è sottoposta ad un controllo fine che può essere turbato da fattori interni ed esterni. Inizialmente si era pensato che l’utilizzo a pioggia di antiossidanti avrebbe potuto ridurre il danno ossidativo a livello dei mitocondri, ma un gran numero di lavori ha mostrato che questo effetto protettivo non soltanto non c’è, ma che una somministrazione indiscriminata di antiossidanti può interferire pesantemente con i normali processi fisiologici, con conseguenze opposte a quelle cercate.
Ci sono però due interventi che si sono dimostrati efficaci nel mantenere una buona funzionalità mitocondriale, interventi relativamente semplici, che richiedono un po’ di buona volontà: restrizione calorica e attività fisica. [5, 6, 7, 8, 9, 10, 11]
Mitocondri in forma: attività fisica e restrizione calorica
La restrizione calorica (RC) è uno dei pochi interventi in grado di aumentare la longevità in un gran numero di esseri viventi, dai moscerini della frutta ai macachi. Ci sono anche indicazioni interessanti per l’uomo, dove la restrizione calorica migliora molti dei parametri legati a processi infiammatori e numerose patologie.
La restrizione calorica, con la ridotta disponibilità di nutriente che ne è immediata conseguenza, agisce sui mitocondri in maniera controintuitiva, aumentando l’attività degli elementi della catena respiratoria e allo stesso tempo riducendo la produzione di radicali liberi. In RC il flusso di elettroni essenziale per la sintesi di ATP è molto più efficiente e subisce perdite minori, mentre l’attivazione di alcune proteine segnale come SIRT-1 e SIRT-3 porta ad un aumento della sintesi degli enzimi antiossidanti che costituiscono la formidabile barriera ossidativa del mitocondrio e all’attivazione di proteine chiave, come PGC-1α, che controllano i processi di autofagia e di sintesi dei mitocondri: il risultato netto è l’eliminazione degli organelli disfunzionali, sostituiti da strutture nuove, attive ed efficienti, in grado di produrre tanta energia “inquinando” poco.
L’attività fisica, soprattutto l’attività di tipo aerobico, agisce mimando al restrizione calorica, creando una situazione di leggero stress che attiva le vie di segnale che fanno capo a SIRT-1, PGC-1α, AMPK e FOXO, con l’effetto complessivo di rendere più forte la barriera antiossidante, aumentare l’efficienza dei mitocondri, eliminare gli organelli invecchiati e sostituirli con elementi nuovi.
Diversi studi hanno mostrato che due-tre mesi di attività di intensità moderata (dal 50 al 70% della frequenza cardiaca massima) stimola la sintesi di nuovi mitocondri e ne migliora funzionalità ed efficienza, con effetti apprezzabili sia grazie ad attività di tipo aerobico sia grazie ad attività di forza. L’esercizio, oltre che agire direttamente sui mitocondri, favorisce anche l’eliminazione di strutture cellulari danneggiate — proteine, lipidi etc — elementi che nel lungo periodo giocano un ruolo non secondario nei processi di senescenza. Inoltre, l’esercizio riduce l’infiammazione sistemica, riduce la quantità di sostanza proinfiammatorie circolanti e stimola la proliferazione e l’attività dei vari gruppi di cellule coinvolte nella risposta immunitaria. [12, 13, 14]
Dieta ed esercizio si confermano strumenti potenti per mantenere in buone condizioni l’intero organismo e anche quei piccoli alieni che vivono nelle nostre cellule, produttori di energia non instancabili, che vanno mantenuti in condizioni ottimali per ridurre gli inevitabili danni dovuti alle reazioni che avvengono nelle strabilianti strutture che si affollano sulle loro membrane.
Parlare di restrizione calorica — una riduzione del 20-30% dell’apporto calorico con apporto adeguato di tutti i nutrienti — non è certo piacevole ma è necessario in un mondo che ha fatto dell’abbondanza in tavola il proprio orgoglio e, purtroppo, anche la fonte di molti dei problemi che ci attanagliano, da quelli che riguardano la nostra salute a quelli che interessano l’ambiente. Ridurre i nostri consumi, ripensare quantità e qualità di quello che mangiamo, è ormai un imperativo e, come abbiamo appena visto, è anche una mossa estremamente positiva per il nostro benessere.
Accanto alla dieta, è essenziale lavorare sul movimento, dalla semplice attività fisica fino all’esercizio mirato a obiettivi più o meno ambiziosi. Siamo fatti per muoverci, la sedentarietà è un nemico formidabile che fa invecchiare in maniera prematura il nostro organismo.
Si tratta di due ambiti d’intervento in cui la nostra volontà è l’unico limite, che ci costano magari in termini di pianificazione e tempo ma che ci restituiscono il nostro investimento in salute, benessere e serenità. Ne vale la pena.
E i mitocondri, sentitamente, ringraziano.